A modern orvostudomány területén az antibiotikumok az egyik legjelentősebb előrelépésnek bizonyultak, drámaian csökkentve a mikrobiális fertőzések előfordulási gyakoriságát és halálozási arányát. A bakteriális fertőzések klinikai kimenetelének megváltoztatására való képességük számtalan beteg várható élettartamát meghosszabbította. Az antibiotikumok kritikus fontosságúak az összetett orvosi eljárásokban, beleértve a műtéteket, az implantátumok beültetését, a transzplantációkat és a kemoterápiát. Az antibiotikum-rezisztens kórokozók megjelenése azonban egyre nagyobb aggodalomra ad okot, ami idővel csökkenti ezen gyógyszerek hatékonyságát. Az antibiotikum-rezisztencia eseteit az antibiotikumok minden kategóriájában dokumentálták, mivel a mikrobiális mutációk előfordulnak. Az antimikrobiális gyógyszerek által kifejtett szelekciós nyomás hozzájárult a rezisztens törzsek megjelenéséhez, ami jelentős kihívást jelent a globális egészségügy számára.
Az antimikrobiális rezisztencia sürgető problémájának leküzdéséhez elengedhetetlen a hatékony fertőzés-ellenőrzési politikák végrehajtása, amelyek korlátozzák a rezisztens kórokozók terjedését, az antibiotikumok felhasználásának csökkentése mellett. Továbbá sürgető szükség van alternatív kezelési módszerekre. A hiperbárikus oxigénterápia (HBOT) ígéretes módszernek bizonyult ebben az összefüggésben, amely 100%-os oxigén belélegzését jelenti meghatározott nyomásszinteken egy bizonyos ideig. A fertőzések elsődleges vagy kiegészítő kezelési módjaként pozicionálva a HBOT új reményt kínálhat az antibiotikum-rezisztens kórokozók által okozott akut fertőzések kezelésében.
Ezt a terápiát egyre inkább alkalmazzák elsődleges vagy alternatív kezelésként különféle állapotok, többek között gyulladás, szén-monoxid-mérgezés, krónikus sebek, ischaemiás betegségek és fertőzések esetén. A HBOT klinikai alkalmazásai a fertőzések kezelésében mélyrehatóak, felbecsülhetetlen előnyöket biztosítva a betegek számára.

A hiperbárikus oxigénterápia klinikai alkalmazása fertőzésekben
A jelenlegi bizonyítékok határozottan alátámasztják a HBOT alkalmazását, mind önálló, mind kiegészítő kezelésként, jelentős előnyökkel járva a fertőzött betegek számára. HBOT során a artériás vér oxigénnyomása 2000 Hgmm-re emelkedhet, és az ebből eredő magas oxigén-szöveti nyomásgradiens a szövetek oxigénszintjét 500 Hgmm-re emelheti. Ezek a hatások különösen értékesek az ischaemiás környezetben megfigyelt gyulladásos válaszok és mikrokeringési zavarok gyógyulásának elősegítésében, valamint a kompartmentszindróma kezelésében.
A HBOT az immunrendszertől függő állapotokra is hatással lehet. A kutatások azt mutatják, hogy a HBOT elnyomhatja az autoimmun szindrómákat és az antigén által kiváltott immunválaszokat, segítve a graft toleranciájának fenntartását azáltal, hogy csökkenti a limfociták és leukociták keringését, miközben modulálja az immunválaszokat. Ezenkívül a HBOTtámogatja a gyógyulástkrónikus bőrelváltozásokban az angiogenezis stimulálásával, ami kritikus fontosságú folyamat a jobb felépülés érdekében. Ez a terápia elősegíti a kollagén mátrix képződését is, ami a sebgyógyulás elengedhetetlen fázisa.
Különös figyelmet kell fordítani bizonyos fertőzésekre, különösen a mély és nehezen kezelhető fertőzésekre, mint például a nekrotizáló fasciitis, az osteomyelitis, a krónikus lágyrészfertőzések és a fertőző endocarditis. A HBOT egyik leggyakoribb klinikai alkalmazása a bőr-lágyrészfertőzések és az alacsony oxigénszinttel összefüggő osteomyelitis, amelyeket gyakran anaerob vagy rezisztens baktériumok okoznak.
1. Diabéteszes lábfertőzések
Diabéteszes lábA fekélyek gyakori szövődményt jelentenek a cukorbetegek körében, a populáció akár 25%-át is érinthetik. Ezekben a fekélyekben gyakran alakulnak ki fertőzések (az esetek 40-80%-át teszik ki), amelyek fokozott morbiditáshoz és mortalitáshoz vezetnek. A diabéteszes lábfertőzések (DFI-k) általában polimikrobiális fertőzésekből állnak, amelyekben számos anaerob bakteriális kórokozót azonosítottak. Különböző tényezők, beleértve a fibroblaszt funkciózavarokat, a kollagénképződési problémákat, a sejtes immunmechanizmusokat és a fagocitafunkciót, akadályozhatják a sebgyógyulást cukorbeteg betegeknél. Számos tanulmány azonosította a bőr oxigénellátásának károsodását, mint a DFI-kkel kapcsolatos amputációk erős kockázati tényezőjét.
A DFI kezelésének egyik jelenlegi lehetőségekéntA HBOT-ról kimutatták, hogy jelentősen javítja a diabéteszes lábfekélyek gyógyulási arányát, ezáltal csökkentve az amputációk és a bonyolult sebészeti beavatkozások szükségességét. Nemcsak minimalizálja az erőforrás-igényes beavatkozások, például a lebenyműtétek és a bőrátültetés szükségességét, hanem alacsonyabb költségekkel és minimális mellékhatással is jár a sebészeti lehetőségekhez képest. Chen és munkatársai által végzett tanulmány kimutatta, hogy több mint 10 HBOT-kezelés 78,3%-os javulást eredményezett a sebgyógyulási arányban cukorbetegeknél.
2. Nekrotizáló lágyrészfertőzések
A nekrotizáló lágyrészfertőzések (NSTI-k) gyakran polimikrobiálisak, jellemzően aerob és anaerob bakteriális kórokozók kombinációjából erednek, és gyakran gázképződéssel járnak. Bár az NSTI-k viszonylag ritkák, gyors lefolyásuk miatt magas halálozási arányt mutatnak. Az időben történő és megfelelő diagnózis és kezelés kulcsfontosságú a kedvező eredmények eléréséhez, és a HBOT-t kiegészítő módszerként ajánlják az NSTI-k kezelésében. Bár a HBOT NSTI-kben történő alkalmazásával kapcsolatban továbbra is vita van a prospektív, kontrollált vizsgálatok hiánya miatt,A bizonyítékok arra utalnak, hogy ez összefüggésben állhat a túlélési arányok javulásával és a szervmegőrzéssel NSTI-betegeknél.Egy retrospektív vizsgálat a HBOT-ban részesülő NSTI-betegek halálozási arányának jelentős csökkenését mutatta ki.
1.3 Sebészeti fertőzések
A sebészeti helyi fertőzések (SSI) a fertőzés anatómiai helye alapján osztályozhatók, és különféle kórokozókból eredhetnek, beleértve az aerob és anaerob baktériumokat is. A fertőzés-ellenőrzési intézkedések, például a sterilizálási technikák, a profilaktikus antibiotikumok alkalmazása és a sebészeti gyakorlatok fejlődése ellenére a SSI-k továbbra is állandó szövődményt jelentenek.
Egy jelentős áttekintés vizsgálta a HBOT hatékonyságát a mély SSI-k megelőzésében neuromuszkuláris szkoliózis műtétek során. A műtét előtti HBOT jelentősen csökkentheti a SSI-k előfordulását és elősegítheti a sebgyógyulást. Ez a non-invazív terápia olyan környezetet teremt, ahol a seb szöveteiben megemelkedik az oxigénszint, ami összefüggésben áll a kórokozók elleni oxidatív ölő hatással. Ezenkívül kezeli a csökkent vér- és oxigénszintet, amely hozzájárul a SSI-k kialakulásához. Más fertőzés-kontroll stratégiákon túl a HBOT-t különösen tiszta, szennyezett műtétekhez, például vastagbél- és végbélnyílás-beavatkozásokhoz ajánlották.
1.4 Égési sérülések
Az égési sérüléseket extrém hő, elektromos áram, vegyszerek vagy sugárzás okozza, és magas morbiditási és halálozási arányt okozhatnak. A HBOT (hBot-ot) a sérült szövetek oxigénszintjének növelésével jótékony hatással lehet az égési sérülések kezelésében. Bár az állatkísérletek és a klinikai vizsgálatok vegyes eredményeket mutatnak a következők tekintetében:A HBOT hatékonysága égési sérülések kezelésébenEgy 125 égési sérültet bevonó tanulmány kimutatta, hogy a HBOT nem mutatott szignifikáns hatást a halálozási arányra vagy az elvégzett műtétek számára, de csökkentette az átlagos gyógyulási időt (19,7 nap a 43,8 naphoz képest). A HBOT és az átfogó égési ellátás integrálása hatékonyan kontrollálhatja a szepszist az égési sérülteknél, ami rövidebb gyógyulási időhöz és csökkent folyadékszükséglethez vezet. A HBOT szerepének megerősítéséhez azonban további kiterjedt prospektív kutatásokra van szükség a kiterjedt égési sérülések kezelésében.
1.5 Osteomyelitis
Az oszteomielitisz a csont vagy a csontvelő fertőzése, amelyet gyakran bakteriális kórokozók okoznak. Az oszteomielitisz kezelése kihívást jelenthet a csontok viszonylag gyenge vérellátása és az antibiotikumok csontvelőbe történő korlátozott behatolása miatt. A krónikus oszteomielitist perzisztáló kórokozók, enyhe gyulladás és nekrotikus csontszövet-képződés jellemzi. A refrakter oszteomielitisz olyan krónikus csontfertőzésekre utal, amelyek a megfelelő kezelés ellenére is folytatódnak vagy kiújulnak.
Kimutatták, hogy a HBOT jelentősen javítja az oxigénszintet a fertőzött csontszövetekben. Számos esettanulmány és kohorszvizsgálat azt mutatja, hogy a HBOT javítja az osteomyelitisben szenvedő betegek klinikai eredményeit. Úgy tűnik, hogy különböző mechanizmusokon keresztül fejti ki hatását, beleértve az anyagcsere-aktivitás fokozását, a bakteriális kórokozók elnyomását, az antibiotikumok hatásának fokozását, a gyulladás minimalizálását és a gyógyulás elősegítését.folyamatok. A HBOT után a krónikus, refrakter osteomyelitisben szenvedő betegek 60–85%-ánál a fertőzés elnyomásának jelei mutatkoznak.
1.6 Gombás fertőzések
Világszerte több mint hárommillió ember szenved krónikus vagy invazív gombás fertőzésekben, ami évente több mint 600 000 halálesetet okoz. A gombás fertőzések kezelésének eredményeit gyakran rontják olyan tényezők, mint a megváltozott immunállapot, az alapbetegségek és a kórokozók virulencia jellemzői. A HBOT vonzó terápiás lehetőséggé válik súlyos gombás fertőzések esetén biztonságossága és non-invazív jellege miatt. A tanulmányok azt mutatják, hogy a HBOT hatékony lehet olyan gombás kórokozókkal szemben, mint az Aspergillus és a Mycobacterium tuberculosis.
A HBOT az Aspergillus biofilmképződésének gátlásával fokozza a gombaellenes hatásokat, fokozott hatékonyságot figyelve meg a szuperoxid-diszmutáz (SOD) géneket nem tartalmazó törzsekben. A gombás fertőzések során kialakuló hipoxiás körülmények kihívást jelentenek a gombaellenes gyógyszerek célba juttatása szempontjából, így a HBOT által kiváltott megnövekedett oxigénszint potenciálisan előnyös beavatkozás lehet, bár további kutatások indokoltak.
A HBOT antimikrobiális tulajdonságai
A HBOT által létrehozott hiperoxiás környezet fiziológiai és biokémiai változásokat indít el, amelyek serkentik az antibakteriális tulajdonságokat, így hatékony kiegészítő terápiává válik a fertőzések kezelésében. A HBOT figyelemre méltó hatást mutat az aerob baktériumok és túlnyomórészt az anaerob baktériumok ellen olyan mechanizmusokon keresztül, mint a közvetlen baktericid aktivitás, az immunválasz fokozása és a specifikus antimikrobiális szerekkel való szinergikus hatások.
2.1 A HBOT közvetlen antibakteriális hatásai
A HBOT közvetlen antibakteriális hatása nagyrészt a reaktív oxigénfajták (ROS) keletkezésének tulajdonítható, amelyek közé tartoznak a szuperoxid-anionok, a hidrogén-peroxid, a hidroxilgyökök és a hidroxilionok – amelyek mindegyike a sejtek anyagcseréje során keletkezik.
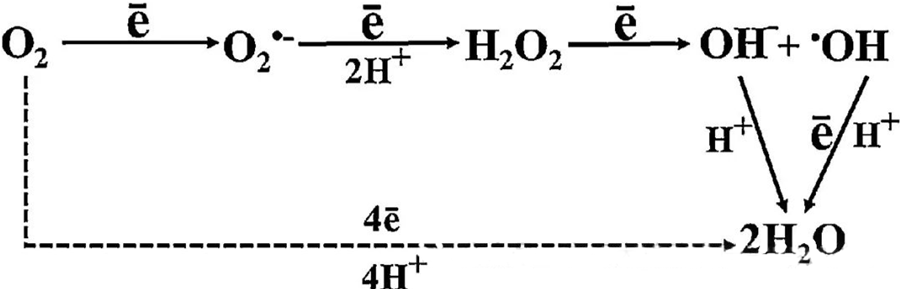
Az O₂ és a sejtes komponensek közötti kölcsönhatás elengedhetetlen a ROS sejtekben történő képződésének megértéséhez. Bizonyos körülmények között, amelyeket oxidatív stressznek nevezünk, a ROS-képződés és lebontása közötti egyensúly felborul, ami a ROS szintjének emelkedéséhez vezet a sejtekben. A szuperoxid (O₂⁻) termelését a szuperoxid-diszmutáz katalizálja, amely ezt követően az O₂⁻-t hidrogén-peroxiddá (H₂O₂) alakítja. Ezt az átalakulást tovább erősíti a Fenton-reakció, amely oxidálja a Fe²⁺-t hidroxilgyökök (·OH) és Fe³⁺ keletkezése közben, ezáltal káros redox folyamatot indítva el, amely a ROS-képződést és a sejtkárosodást idézi elő.
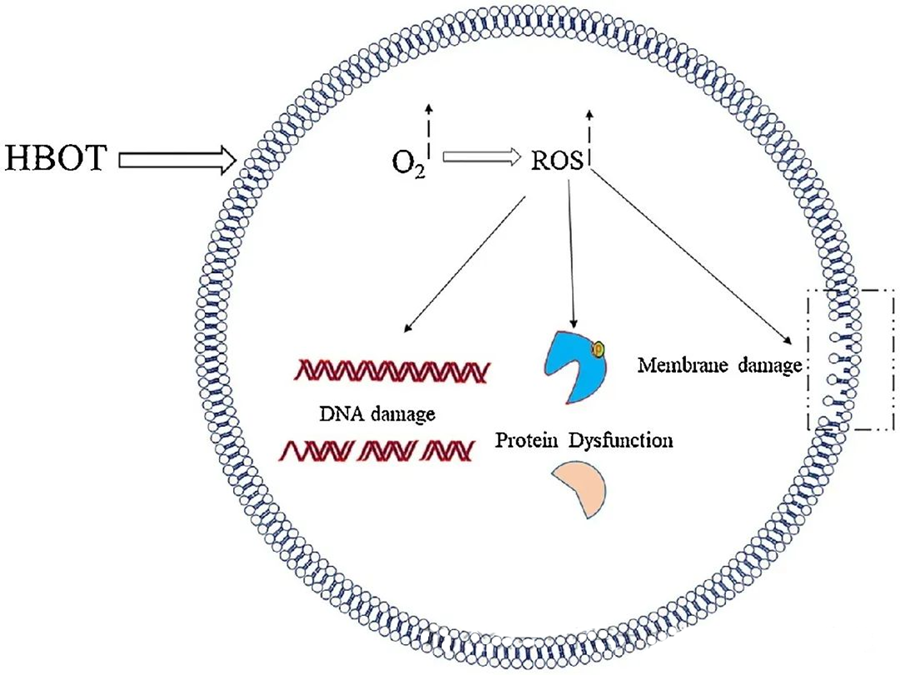
A ROS toxikus hatásai olyan kritikus sejtkomponenseket céloznak meg, mint a DNS, az RNS, a fehérjék és a lipidek. Figyelemre méltó, hogy a DNS a H₂O₂ által közvetített citotoxicitás elsődleges célpontja, mivel megbontja a dezoxiribóz szerkezeteket és károsítja a bázisösszetételeket. A ROS által kiváltott fizikai károsodás kiterjed a DNS hélix szerkezetére, ami potenciálisan a ROS által kiváltott lipidperoxidáció eredménye. Ez rávilágít a megemelkedett ROS-szint káros következményeire a biológiai rendszerekben.
A ROS antimikrobiális hatása
A ROS létfontosságú szerepet játszik a mikrobiális növekedés gátlásában, amint azt a HBOT által kiváltott ROS-képződés is bizonyítja. A ROS toxikus hatásai közvetlenül a sejtalkotókat, például a DNS-t, a fehérjéket és a lipideket célozzák meg. Az aktív oxigénfajták magas koncentrációja közvetlenül károsíthatja a lipideket, ami lipidperoxidációhoz vezethet. Ez a folyamat veszélyezteti a sejtmembránok integritását, és következésképpen a membránhoz kapcsolódó receptorok és fehérjék működését.
Továbbá, a fehérjék, amelyek szintén a ROS jelentős molekuláris célpontjai, specifikus oxidatív módosulásokon mennek keresztül különböző aminosav-maradékokon, mint például a cisztein, metionin, tirozin, fenilalanin és triptofán. Például kimutatták, hogy a HBOT oxidatív változásokat indukál számos fehérjében az E. coliban, beleértve az elongációs faktor G-t és a DnaK-t, ezáltal befolyásolva azok sejtfunkcióit.
Az immunitás fokozása HBOT-n keresztül
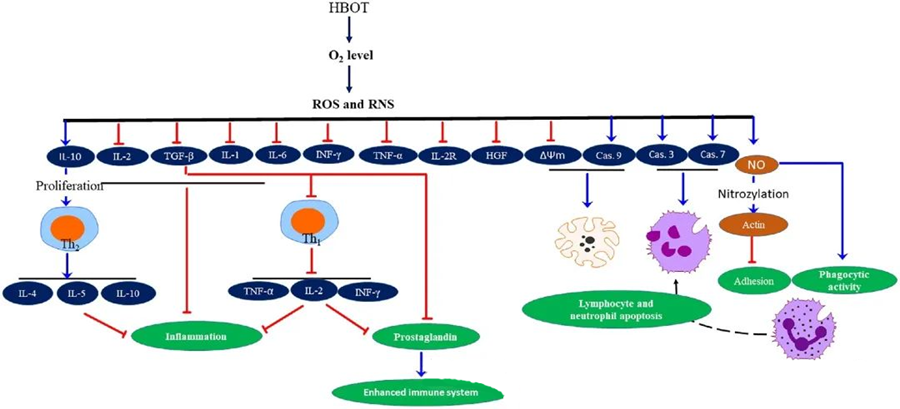
A HBOT gyulladáscsökkentő tulajdonságaidokumentálták, amelyek kulcsfontosságúnak bizonyultak a szövetkárosodás enyhítésében és a fertőzés progressziójának gátlásában. A HBOT jelentősen befolyásolja a citokinek és más gyulladásos szabályozók expresszióját, befolyásolva az immunválaszt. Különböző kísérleti rendszerek figyeltek meg eltérő változásokat a génexpresszióban és a fehérjetermelésben a HBOT után, amelyek vagy fel-, vagy leszabályozták a növekedési faktorokat és a citokineket.
A HBOT folyamat során a megnövekedett O₂-szint számos sejtes választ vált ki, például gátolja a gyulladáskeltő mediátorok felszabadulását és elősegíti a limfociták és neutrofilek apoptózisát. Ezek a hatások együttesen fokozzák az immunrendszer antimikrobiális mechanizmusait, ezáltal elősegítve a fertőzések gyógyulását.
Továbbá, tanulmányok arra utalnak, hogy a HBOT során megnövekedett O₂-szint csökkentheti a gyulladáskeltő citokinek, köztük az interferon-gamma (IFN-γ), az interleukin-1 (IL-1) és az interleukin-6 (IL-6) expresszióját. Ezek a változások magukban foglalják a CD4:CD8 T-sejtek arányának csökkentését és más oldható receptorok modulálását is, végső soron növelve az interleukin-10 (IL-10) szintet, ami kulcsfontosságú a gyulladás ellensúlyozásában és a gyógyulás elősegítésében.
A HBOT antimikrobiális aktivitása összetett biológiai mechanizmusokkal fonódik össze. Mind a szuperoxid, mind a megnövekedett nyomás inkonzisztensen elősegíti a HBOT által kiváltott antibakteriális aktivitást és a neutrofil apoptózist. A HBOT után az oxigénszint jelentős emelkedése fokozza a neutrofilek baktericid képességét, amely az immunválasz alapvető összetevője. Továbbá a HBOT gátolja a neutrofilek adhézióját, amelyet a neutrofileken található β-integrinek és az endotélsejteken található intercelluláris adhéziós molekulák (ICAM) kölcsönhatása közvetít. A HBOT egy nitrogén-monoxid (NO) által közvetített folyamaton keresztül gátolja a neutrofil β-2 integrin (Mac-1, CD11b/CD18) aktivitását, hozzájárulva a neutrofilek migrációjához a fertőzés helyére.
A citoszkeleton pontos átrendeződése szükséges ahhoz, hogy a neutrofilek hatékonyan fagocitálhassák a kórokozókat. Kimutatták, hogy az aktin S-nitrozilációja stimulálja az aktin polimerizációját, potenciálisan elősegítve a neutrofilek fagocita aktivitását HBOT előkezelés után. Ezenkívül a HBOT mitokondriális útvonalakon keresztül elősegíti az apoptózist az emberi T-sejtvonalakban, és a HBOT után felgyorsult limfocitahalálról számoltak be. A kaszpáz-9 blokkolása – a kaszpáz-8 befolyásolása nélkül – igazolta a HBOT immunmoduláló hatásait.
A HBOT és az antimikrobiális szerek szinergikus hatásai
Klinikai alkalmazásokban a HBOT-t gyakran alkalmazzák antibiotikumokkal együtt a fertőzések hatékony leküzdésére. A HBOT során elért hiperoxiás állapot befolyásolhatja bizonyos antibiotikumok hatékonyságát. A kutatások azt sugallják, hogy bizonyos baktericid gyógyszerek, mint például a β-laktámok, a fluorokinolonok és az aminoglikozidok, nemcsak belső mechanizmusokon keresztül hatnak, hanem részben a baktériumok aerob anyagcseréjére is támaszkodnak. Ezért az oxigén jelenléte és a kórokozók metabolikus jellemzői kulcsfontosságúak az antibiotikumok terápiás hatásainak értékelésekor.
Jelentős bizonyítékok igazolják, hogy az alacsony oxigénszint növelheti a Pseudomonas aeruginosa piperacillin/tazobaktámmal szembeni rezisztenciáját, és hogy az alacsony oxigénszint szintén hozzájárul az Enterobacter cloacae azitromicinnel szembeni fokozott rezisztenciájához. Ezzel szemben bizonyos hipoxiás állapotok fokozhatják a baktériumok érzékenységét a tetraciklin antibiotikumokkal szemben. A HBOT életképes kiegészítő terápiás módszerként szolgál az aerob anyagcsere indukálásával és a hipoxiás fertőzött szövetek reoxigenizációjával, ezáltal növelve a kórokozók antibiotikumokkal szembeni érzékenységét.
Preklinikai vizsgálatokban a HBOT – naponta kétszer 8 órán át 280 kPa nyomáson adagolva – és a tobramicin (20 mg/kg/nap) együttes alkalmazása jelentősen csökkentette a bakteriális terhelést a Staphylococcus aureus fertőző endocarditisében. Ez bizonyítja a HBOT kiegészítő kezelésként való potenciálját. További vizsgálatok kimutatták, hogy 37°C-on és 3 ATA nyomáson 5 órán át a HBOT jelentősen fokozta az imipenem hatását a makrofágokkal fertőzött Pseudomonas aeruginosa ellen. Ezenkívül a HBOT és a cefazolin kombinált kezelése állatmodellekben hatékonyabbnak bizonyult a Staphylococcus aureus osteomyelitis kezelésében, mint a cefazolin önmagában.
A HBOT jelentősen fokozza a ciprofloxacin baktericid hatását a Pseudomonas aeruginosa biofilmekkel szemben, különösen 90 perces expozíció után. Ez a fokozódás az endogén reaktív oxigénfajták (ROS) képződésének tulajdonítható, és fokozott érzékenységet mutat a peroxidáz-hibás mutánsokban.
A meticillin-rezisztens Staphylococcus aureus (MRSA) által okozott mellhártyagyulladás modelljeiben a vankomicin, a teikoplanin és a linezolid HBOT-val való együttes hatása szignifikánsan megnövekedett hatékonyságot mutatott az MRSA ellen. A metronidazol, egy antibiotikum, amelyet széles körben alkalmaznak súlyos anaerob és polimikrobiális fertőzések, például diabéteszes lábfertőzések (DFI-k) és műtéti fertőzések (SSI-k) kezelésében, nagyobb antimikrobiális hatékonyságot mutatott anaerob körülmények között. További vizsgálatokra van szükség a HBOT és a metronidazol kombinációjának szinergikus antibakteriális hatásainak feltárására mind in vivo, mind in vitro körülmények között.
A HBOT antimikrobiális hatékonysága a rezisztens baktériumokkal szemben
A rezisztens törzsek fejlődésével és terjedésével a hagyományos antibiotikumok idővel gyakran veszítenek hatékonyságukból. Továbbá a HBOT elengedhetetlennek bizonyulhat a multirezisztens kórokozók okozta fertőzések kezelésében és megelőzésében, kritikus stratégiaként szolgálva, amikor az antibiotikumos kezelések kudarcot vallanak. Számos tanulmány számolt be a HBOT jelentős baktericid hatásáról a klinikailag releváns rezisztens baktériumokra. Például egy 90 perces HBOT-kezelés 2 ATM-en jelentősen csökkentette az MRSA szaporodását. Ezenkívül az aránymodellekben a HBOT fokozta a különböző antibiotikumok antibakteriális hatását az MRSA-fertőzésekkel szemben. A jelentések megerősítették, hogy a HBOT hatékony az OXA-48-at termelő Klebsiella pneumoniae által okozott osteomyelitis kezelésében anélkül, hogy bármilyen kiegészítő antibiotikumra lenne szükség.
Összefoglalva, a hiperbárikus oxigénterápia sokrétű megközelítést képvisel a fertőzések kontrolljában, fokozza az immunválaszt, miközben felerősíti a meglévő antimikrobiális szerek hatékonyságát. Átfogó kutatással és fejlesztéssel potenciálisan enyhítheti az antibiotikum-rezisztencia hatásait, reményt adva a bakteriális fertőzések elleni küzdelemben.
Közzététel ideje: 2025. február 28.

